funciones químicas
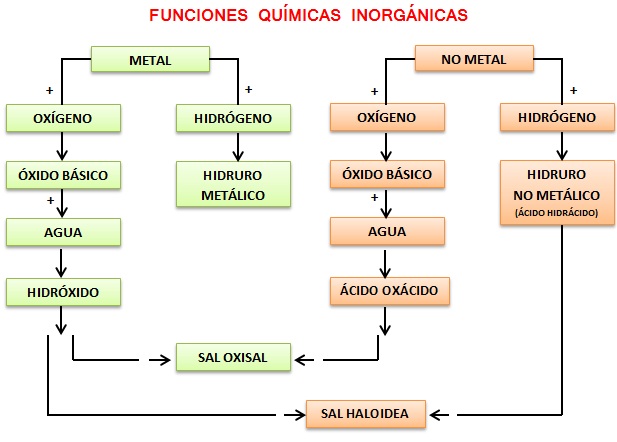
ÓXIDOS
Compuestos binarios que se forman al combinarse un elemento + O2 → Óxido pueden ser:
· Óxidos Básicos o Metálicos MO
Compuestos binarios que se forman al combinarse un Metal + O2 → Óxido Básico
Ejemplo: Forma y Nombra los óxidos del Cobre
Cu+1 + O2 → Cu2O1 → Cu2O
|
NOMENCLATURA SISTEMÁTICA O ESTEQUIOMÉTRICA |
NOMENCLATURA STOCK-WERNER |
NOMENCLATURA TRADICIONAL O COMÚN O CLÁSICA |
|
Dióxido de cobre |
Óxido de cobre (I) |
Óxido cuprOSO |
Cu+2 + O2 → Cu2O2 → CuO
|
Monóxido de cobre |
Óxido de cobre (II) |
Óxido cúprICO |
· Óxidos Ácidos o Anhídridos XO
Compuestos binarios que se forman al combinarse un No Metal + O2 → Óxido Ácido
Ejemplo: Forma y Nombra los óxidos del Cloro
Cl+1 + O2 → Cl2O
|
NOMENCLATURA ESTEQUIOMÉTRICA O SISTEMÁTICA |
NOMENCLATURA STOCK-WERNER |
NOMENCLATURA TRADICIONAL O COMÚN O CLÁSICA |
|
Monóxido de dicloro |
Óxido de cloro (I) |
Óxido HIPOclorOSO |
Cl+3 + O2 → Cl2O3
|
Trióxido de dicloro |
Óxido de cloro (III) |
Óxido clorOSO |
Cl+5 + O2 → Cl2O5
|
Pentaóxido de dicloro |
Óxido de cloro (V) |
Óxido clorICO |
Cl+7 + O2 → Cl2O7
|
Heptaóxido de dicloro |
Óxido de cloro (VII) |
Óxido PERclorICO |
· Óxidos Anfóteros
Algunos óxidos pueden reaccionar ante ácidos fuertes generando óxidos débilmente básicos y ante bases fuertes generando óxidos débilmente ácidos. Ej: Al2O3, ZnO, MnO2, PbO, PBO2,SnO2, SnO, Au2O3, Fe2O3, Cr2O3.
· Óxidos Neutros
No funcionan como óxidos ácidos ni básicos y tampoco son peróxidos. Ej: CO, NO, N2O, H2O.
· Óxidos Mixtos
Son óxidos formados por dos óxidos del mismo metal con diferentes grados de oxidación. Ej: 2PbO + PbO2 → Pb3O4 Óxido plumboso plúmbico, FeO + Fe2O3 → Fe3O4 Óxido ferroso férrico.
· Óxidos Superóxidos
Son sólidos iónicos formados por Na, K, Rb y Cs, contienen Oxígeno con número de oxidación -1/2 (O-1/2). Ej: NaO2, KO2, RbO2, SrO2.
· Peróxidos
Son óxidos sólidos que contienen el grupo –O–O– donde el oxígeno tiene estado de oxidación -1 (O-1). Ej: H2O2, Na2O2, K2O2, BaO2.
BASES O HIDRÓXIDOS O ALCALIS Mn(OH)n
Fórmula general Mn(OH)n. Presentan un metal (M) con su respectivo número de oxidación n y el grupo hidroxilo (OH)-1 con número de oxidación -1. Se forman al combinarse un Óxido Básico + H2O → Base o Hidróxido Ej: Haga el proceso de formación del Mg(OH)2 Hidróxido de Magnesio (Mg+2): MgO + 2H2O → 2Mg(OH)2
Así, por ejemplo, la fórmula de las bases o hidróxidos del hierro, aluminio, sodio y cobre pueden nombrarse:
|
COMPUESTO |
NOMENCLATURA ESTEQUIOMÉTRICA O SISTEMÁTICA |
NOMENCLATURA STOCK-WERNER |
NOMENCLATURA TRADICIONAL O COMÚN O CLÁSICA |
|
Fe(OH)2 |
Dihidróxido de hierro |
Hidróxido de hierro (II) |
Hidróxido ferrOSO |
|
Fe(OH)3 |
Trihidróxido de hierro |
Hidróxido de hierro(III) |
Hidróxido férrICO |
|
Al(OH)3 |
Trihidróxido de aluminio |
Hidróxido de aluminio(III) |
Hidróxido de aluminio |
|
NaOH |
Hidróxido de sodio |
Hidróxido de sodio (I) |
Hidróxido de sodio |
|
CuOH |
Hidróxido de cobre |
Hidróxido de cobre (I) |
Hidróxido cuprOSO |
|
Cu(OH)2 |
Dihidróxido de cobre |
Hidróxido de cobre (II) |
Hidróxido cúprICO |
ÁCIDOS
Sustancias con sabor agrio que en solución acuosa liberan iones H+.
ÁCIDOS HIDRÁCIDOS HX
Son compuestos binarios que se forman al combinarse Hidrógeno con unos muy pocos no metales de los grupos VIA y VIIA. H + No Metal → Hidrácido. El número de oxidación de H es +1 y el del No Metal es negativo.
Para nombrarlos la IUPAC recomienda usar la palabra Ácido seguido de la raíz del No Metal (S-2, F-1, Cl-1, Br-1, I-1) y el sufijo hídrico.
Ejemplos:
HCl Ácido Clorhídrico (H+1Cl-1), H2S Ácido Sulfhídrico (H2+1S-2).
Hay un grupo de compuestos parecidos pero no son hidrácidos, ya que no tienen propiedades ácidas y son: El amoníaco NH3, la fosfina PH3, el metano CH4, el silano SiH4 y la arsina AsH3.
ÁCIDOS OXÁCIDOS HXO
Compuestos ternarios que se forman al combinarse un óxido ácido o anhídrido con agua.
Óxido ácido + H2O → Oxácido
Nomenclatura sustituir la palabra óxido del óxido ácido por la palabra ácido El número de oxidación del Hidrógeno H es +1 y el del Oxígeno O es -2.
Ejercicio desarrollado:
Hacer la ecuación de la reacción de formación del ácido sulfúrico H2SO4 y determinar sus estados de oxidación.
Solución:
1) Debes formar primero el óxido sulfúrico (el azufre S trabaja con +2, +4, +6) S+6 + O2 → S2O6 → SO3 y luego combinar el óxido sulfúrico con agua para formar el ácido sulfúrico H2O + SO3 → H2SO4
2) Estados de oxidación: H2+1S-6O4-2 (los estados de oxidación deben sumar cero) hhhhhhhhhhhhhhhhhh+2 +6 -8 =0
Ejercicio desarrollado:
Hacer la ecuación de la reacción de formación del ácido fosfórico H3PO4 y determinar sus estados de oxidación.
Solución:
1) Debes formar primero el óxido fosfórico (el fósforo P trabaja con +3, +5) P+5 + O2 → S2O5 → P2O5 y luego combinar el óxido fosfórico con 3 moles agua para formar el ácido fosfórico (las formas más estables de los óxidos fosforoso y fosfórico usan 3 moles de agua) 3H2O + P2O5 → H6P2O6 → H3PO4
2) Estados de oxidación: H3+1P-5O4-2 (los estados de oxidación deben sumar cero) mmmmmmmmmmmm +3 +5 -8 =0
SALES
Compuestos binarios, ternarios o cuaternarios que provienen del ácido y la base involucradas.
PRINCIPALES CATIONES PRINCIPALES ANIONES
|
Símbolo |
Nombre |
símbolo |
nombre |
símbolo |
nombre |
símbolo |
nombre |
|
Zn+2 |
Zinc |
Sn+2 |
Estaño(II) o estañoso |
F-1 |
Fluoruro |
HCO3-1 |
Bicarbonato |
|
NH4+1 |
Amonio |
Sn+3 |
Estaño(III) o estáñico |
Cl-1 |
Cloruro |
NO2-1 |
Nitrito |
|
Ag+1 |
Ión Plata |
Pb+2 |
Plomo(II) o plumboso |
Br -1 |
Bromuro |
NO3-1 |
Nitrato |
|
Símbolo |
Nombre |
símbolo |
nombre |
símbolo |
nombre |
símbolo |
nombre |
|
Cu+1 |
Cobre(I) o cuproso |
Pb+3 |
Plomo(IV) o plúmbico |
I-1 |
Yoduro |
SO3-2 |
Sulfito |
|
Cu+2 |
Cobre(II) o cúprico |
Pt+2 |
Platino(II) o platinoso |
S-2 |
Sulfuro |
SO4-2 |
Sulfato |
|
Hg+1 |
Mercurio(I) o mercurioso |
Pt+3 |
Platino(IV) o platínico |
CN-1 |
Cianuro |
CO2-2 |
Carbonito |
|
Hg+2 |
Mercurio(II) o mercúrico |
Pd+4 |
Paladio(IV) o paládico |
ClO-1 |
Hipoclorito |
CO3-2 |
Carbonato |
|
Au+1 |
Oro(I) o auroso |
Fe+2 |
Hierro(II) o ferroso |
ClO2-1 |
Clorito |
PO3-3 |
Fosfito |
|
Au+3 |
Oro(III) o áurico |
Fe+3 |
Hierro(III) o férrico |
ClO3-1 |
Clorato |
PO4-3 |
Fosfato |
|
Ni+2 |
Níquel(II) o niqueloso |
Co+2 |
Cobalto(II) o cobaltoso |
ClO4-1 |
Perclorato |
CrO4-2 |
Cromato |
|
Ni+3 |
Níquel(III) o niquélico |
Co+3 |
Cobálto(III) o cobáltico |
MnO4-1 |
Permanga- nato |
CrO7-2 |
Bicarbonato |
|
Mg+2 |
Ión Magnesio |
H+1 |
Ión Hidrógeno |
BrO--1 |
Hipobromito |
BrO3-1 |
Bromato |
|
H3O*1 |
Ión Hidronio |
Al+3 |
Ión Aluminio |
BrO2-1 |
Bromito |
OH-1 |
Ión Hidroxilo |
SALES HIDRACIDAS MX
Se forman al combinarse un hidrácido con una base o hidróxido, mediante un proceso de neutralización
hidrácido + base → sal hidrácida + agua
Nomenclatura, sustituir del hidrácido el sufijo hídrico por uro y culminar nombrando el metal de la base.
Ejercicio desarrollado:
Hacer la ecuación de la reacción de formación del cloruro de sodio.
Solución:
Formar primero el hidrácido H+1 + Cl-1 → HCl ácido clorhídrico y luego combinarlo con la base o hidróxido del sodio (Na+1) = NaOH
HCl + NaOH → NaCl + H2O
SALES OXÁCIDAS MXO
Se forman al combinarse un oxácido con una base o hidróxido, mediante un proceso de neutralización
oxácido + base → sal oxácida + agua
Nomenclatura, sustituir del ácido los sufijos oso por ito y culminar nombrando el metal de la base.
Ejercicio desarrollado:
Hacer la ecuación de la reacción de formación del perclotato férrico y determinar sus estados de oxidación.
Solución:
1) Formar primero el óxido perclórico (el cloro Cl trabaja con +/-1, +3, +5, +7) Cl+7 + O2 → Cl2O7 y luego combinar el óxido perclórico con agua para formar el ácido perclórico.
H2O + Cl2O7 → H2Cl2O8 → HClO4 y luego combinamos el oxácido con la base o hidróxido del hierro
Fe+3 para formar la respectiva sal oxácida perclorato férrico más agua HClO4 + Fe(OH)3 → Fe(ClO4)3 + H2O
2) Estados de oxidación: Fe+3(Cl-7O-24)3-1 (los estados de oxidación deben sumar cero) h
+3 -3 =0
SALES ÁCIDAS MHXO
Sales que presentan un anión hidrogenado y están en capacidad de suministrar iones H+1. Ejemplo: NaHCO3 hidrogenocarbonato de sodio o bicarbonato de sodio o carbonato ácido de sodio, KH2PO4 dihidrogenofosfato de potasio o fosfato diácido de potasio.
SALES BÁSICAS M(OH)XO
Sales que presentan que presentan iones hidroxilo OH-1. Ejemplo: Ca(OH)Cl hidroxicloruro de calcio o cloruro básico de calcio, Al(OH)2NO2 dihidroxinitrito de aluminio o nitrito dibásico de aluminio.
SALES DOBLE MMXO
Sales que se obtienen cuando un ácido reacciona con dos bases de diferentes metales
Ejemplo: H2SO4 + KOH + NaOH → KNaSO4 + 2H2O sulfato de sodio y potasio KNaSO4
H3PO3 + Ca(OH)2 + NaOH → CaNaPO3 + 3H2O fosfito de sodio y calcio CaNaPO3