reacciones químicas
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de cada una de las reacciones se le denomina ecuación química.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
¿POR QUÉ SE PRODUCEN LAS REACCIONES QUÍMICAS?
Una reacción química es la transformación de una sustancia en otra.
A las sustancias en que reaccionan se les denomina REACTANTES. A las nuevas sustancias se les denomina: PRODUCTOS.
Para que una reacción química se realice se debe presentar en primer lugar una “RUPTURA” de los enlaces de los reactantes. Lo anterior hace posible la formación de “NUEVOS ENLACES “, es decir, “NUEVOS COMPUESTOS” (PRODUCTOS).
¿QUÉ ES UNA ECUACIÓN QUÍMICA?
Las reacciones químicas se representan mediante “ECUACIONES QUÍMICAS”. Una reacción química es la forma como se simboliza una reacción química.
Las sustancias que reaccionan se escriben primero, seguidas de una flecha y luego se escribe los productos, así:
C + O2 à CO2
Reactantes à Producto
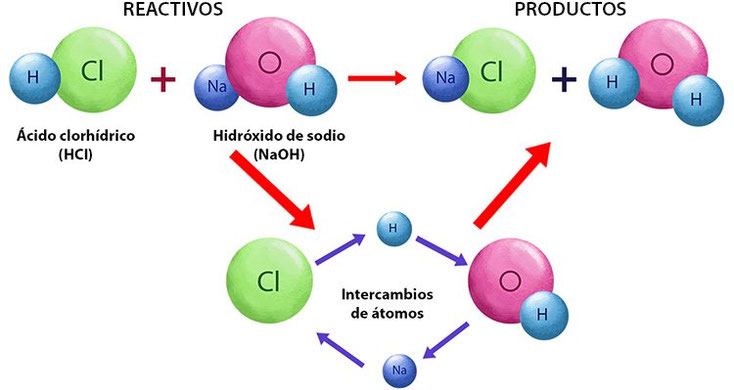
NaOH + HCl à NaCl + H2O
Hidróxido de Sodio + Ácido Clorhídrico à Cloruro + Agua de Sodio
Reactantes à Producto
CARACTERÍSTICAS DE UNA ECUACIÓN
La ecuación química debe indicar el estado físico de los reactivos y productos. Para ello se emplean los siguientes símbolos:
(g) = Representa el Estado Gaseoso
(e) = Representa el Estado Líquido
(s) = Representa el Estado Sólido
(ac) = Representa una Disolución Acuosa
Usualmente estos símbolos se omiten y sólo se usan cuando es estrictamente necesario.
En la ecuación se deben identificar los “CATALIZADORES”. Los catalizadores son sustancias que permiten acelerar o retardar una reacción.
Los catalizadores se deben escribir sobre la flecha que separa los reactivos de los productos.
En toda reacción química se representa absorción o desprendimiento de energía. Una reacción que desprende energía se conoce como EXOTÉRMICA.
Cuando la reacción absorbe energía se le denomina ENDOTÉRMICA.